OCT-angiographie : quelles applications dans le glaucome ?
L’étude structurale du nerf optique repose depuis plusieurs années sur la tomographie en cohérence optique (OCT), avec la mesure de l’épaisseur de la couche des fibres nerveuses rétiniennes péripapillaires (RNFL) et l’analyse du complexe ganglionnaire maculaire (GCC). Ces dernières, en constituant des paramètres objectifs et reproductibles, ont permis de faciliter la prise en charge du patient glaucomateux. Alors que de nombreuses études épidémiologiques retrouvent une association entre glaucome et troubles du débit sanguin oculaire [1], son exploration in vivo a longtemps été limitée par la complexité et le manque de résolution des techniques d’imagerie disponibles. En permettant une analyse précise de l’architecture vasculaire rétinienne, l’OCT angiographie (OCT-A) semble susciter un intérêt croissant dans l’étude de la neuropathie glaucomateuse.
Rappels anatomiques et principes de fonctionnement
La vascularisation de la portion antérieure du nerf optique provient principalement des artères ciliaires courtes postérieures, à l’exception de la couche superficielle des fibres nerveuses rétiniennes, vascularisée par l’artère centrale de la rétine. Historiquement, l’étude de la vascularisation rétinienne reposait sur l’angiographie rétinienne, méthode invasive permettant d’obtenir des images bidimensionnelles et de résolution limitée. Afin de pallier ces limites, l’imagerie vasculaire rétinienne a connu de nombreuses avancées ces dernières années, avec notamment le développement de technologies non invasives.
L’OCT-A, apparue pour la première fois en 2006, est une technique d’imagerie dans laquelle les globules rouges sont utilisés comme agents de contraste intrinsèques afin de créer des images tridimensionnelles de réseaux microvasculaires. La capture répétée de coupes sur le même plan d’acquisition rétinien permet de mesurer les changements de réflexion induits par les globules rouges en mouvement circulant au sein des vaisseaux sanguins.
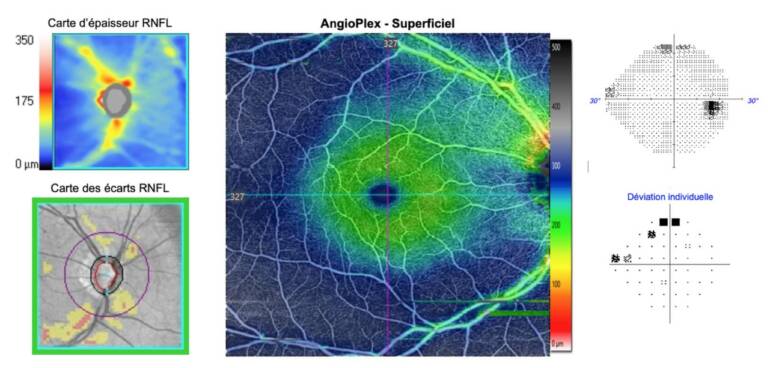
Malgré l’existence d’algorithmes de traitements et d’extractions spécifiques des images (SSADA, OMAG, OCTARA…), une des limites de l’OCT-A est sa difficulté à réaliser des images des réseaux microvasculaires profonds de la tête du nerf optique et de la choroïde péripapillaire. En effet, les vaisseaux rétiniens profonds sont souvent obscurcis ou masqués par les vaisseaux sanguins superficiels de plus gros calibre. Ainsi, les mesures des vaisseaux superficiels péripapillaires et maculaires sont devenues le centre d’intérêt de la recherche dans le domaine du glaucome. Bien que le flux vasculaire réel ne puisse être directement analysé, plusieurs paramètres quantitatifs peuvent être calculés. En pratique, la densité vasculaire, qui est définie comme le pourcentage de pixels occupés par des vaisseaux sanguins dans l’aire étudiée, constitue le principal indice analysé. En effet, ce paramètre présente une bonne reproductibilité chez les sujets sains et les patients glaucomateux. Plus précisément, son coefficient de répétabilité est proche de 7% dans la région péripapillaire, ce qui signifie que tout changement de la densité vasculaire inférieure à ce seuil serait cliniquement insignifiant. Les autres indices calculés, notamment de flux, sont moins reproductibles et donc moins utilisés en pratique.
Intérêt dans le diagnostic
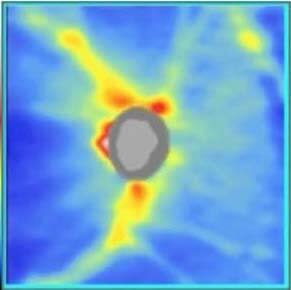
Depuis 2015, l’application de l’OCT-A dans le glaucome a permis de détecter une diminution de la densité vasculaire dans la région péripapillaire et maculaire superficielle chez les sujets glaucomateux par rapport aux sujets sains [2]. Les performances diagnostiques de l’OCT-A semblent similaires à celles des autres paramètres OCT (RNFL et GCC) pour différencier les yeux glaucomateux des yeux sains, et cela dès le stade prépérimétrique. Chez les sujets glaucomateux, des études récentes ont également mis en évidence une forte corrélation entre cette microarchitecture vasculaire et les autres paramètres OCT (RNFL et GCC), avec la localisation et la sévérité des atteintes au champ visuel (figure) [3]. Par ailleurs, la corrélation entre les paramètres d’OCT-A et le champ visuel pourrait être meilleure que celle observée entre les autres paramètres OCT et le champ visuel, notamment chez les patients avec une forte myopie et un glaucome avancé. Néanmoins, même si les corrélations entre l’atteinte observée en OCT-A et les autres modalités d’évaluation du glaucome sont bonnes, la très grande variabilité des paramètres utilisés en OCT-A et surtout l’absence de base normative sur les paramètres quantitatifs de cette modalité limitent son utilisation en pratique dans cette indication.
Intérêt dans l’évaluation de la progression
La publication d’études longitudinales récentes semble confirmer la capacité de l’OCT-A à détecter une progression de la neuropathie glaucomateuse à travers une diminution de la densité vasculaire, ce qui permet, en utilisant les mesures initiales du patient comme référence, de se passer de bases de données normatives. La combinaison de l’analyse en OCT-A avec les paramètres structurels d’OCT classiques semble augmenter leur sensibilité [4]. Par ailleurs, l’utilisation des paramètres d’OCT-A pourrait être intéressante dans le glaucome avancé, avec un effet plancher atteint plus tardivement (autour d’une déviation totale de -25 dB au champ visuel), par rapport aux paramètres OCT classiques (-17,5 dB pour l’épaisseur RNFL et -12 dB pour celle du GCC) [5]. À l’image des limites de son utilisation diagnostique, l’OCT-A nécessite encore la définition de paramètres précis (localisation, type d’analyse…) et quantitatifs généralisables, permettant d’évaluer de manière reproductible la progression.
Par ailleurs, à la différence des paramètres structuraux (RNFL ou GCC), qui sont une mesure de paramètres anatomiques peu variable à court terme, la mesure d’un flux ou d’une densité vasculaire reste un paramètre très variable et potentiellement influencé par la pression intraoculaire ou la pression artérielle. Cela limite encore l’utilisation de l’OCT-A en pratique pour l’évaluation de la progression.
Particularités dans les différentes formes de glaucomes
Dans le glaucome à pression normale (GPN), où les phénomènes vasculaires, notamment vasospastiques, semblent être particulièrement impliqués, la densité vasculaire mesurée est plus faible que chez les sujets sains. Néanmoins, aucune différence de mesures n’est retrouvée avec les patients présentant un glaucome primitif à angle ouvert (GPAO).
Dans le glaucome pseudo-exfoliatif (GPEX), l’atteinte microvasculaire semble plus importante que celle présente dans le GPAO. De plus, chez les patients avec un syndrome pseudo-exfoliatif sans neuropathie glaucomateuse, on retrouve également une densité vasculaire plus faible que chez les sujets sains. Ces données pourraient refléter en partie l’atteinte systémique, notamment vasculaire, caractérisant ce syndrome.
Autres applications
La vascularisation conjonctivale est un facteur pronostique important du potentiel succès thérapeutique d’une chirurgie filtrante. En effet, l’existence d’une hyperhémie conjonctivale peut favoriser une cicatrisation épisclérale excessive (encapsulation et fibrose de la bulle de filtration), compromettant la filtration de l’humeur aqueuse dans l’espace sous-conjonctival. Des travaux récents, utilisant l’OCT-A de segment antérieur, ont ainsi réussi à corréler une faible mesure de la densité vasculaire conjonctivale au niveau du futur site de filtration à un meilleur taux de succès chirurgical [6]. De plus, en postopératoire, une faible densité vasculaire de la paroi de la bulle semblerait également liée à un meilleur contrôle tensionnel. L’OCT-A appliquée au segment antérieur pourrait également permettre d’imager la vascularisation profonde intrasclérale représentant partiellement l’écoulement de l’humeur aqueuse posttrabéculaire, avec une indication potentielle dans la prédiction du succès d’une procédure micro-invasive trabéculaire [7].
Limites et recherche future
Le caractère primitif ou secondaire des modifications vasculaires dans le glaucome n’est pas encore totalement élucidé. Plusieurs études ont retrouvé une diminution de la microvascularisation mesurée par OCT-A chez les patients présentant une hypertonie oculaire simple [8]. Cependant, il reste à préciser si cette réduction de la densité vasculaire peut conduire au développement de lésions nerveuses précoces. De plus, l’utilisation de collyres hypotonisants dans ce contexte pourrait également affecter le flux sanguin.
L’OCT-A présente cependant d’autres limites, notamment dans son acquisition, avec des artefacts liés aux mouvements oculaires malgré l’introduction de logiciels de suivi oculaire (eye tracking). Son évaluation peut également être faussée en cas de troubles des milieux et de présence d’une pathologie rétinienne ou neurologique autre que le glaucome.
Bien que peu réalisée en pratique courante, l’OCT-A, en permettant une exploration fine de l’architecture vasculaire rétinienne, pourrait constituer un nouveau biomarqueur structurel et fonctionnel de la neuropathie glaucomateuse. De nouvelles études restent néanmoins nécessaires afin de préciser son apport en pratique clinique et dans la compréhension de la pathogénèse du glaucome.
Références bibliographiques
[1] Bonomi L, Marchini G, Marraffa M et al. Vascular risk factors for primary open angle glaucoma: the Egna-Neumarkt Study. Ophthalmology. 2000;107(7):1287-93.
[2] Liu L, Jia Y, Takusagawa HL et al. Optical coherence tomography angiography of the peripapillary retina in glaucoma. JAMA. 2015; 133(9):1045-52.
[3] WuDunn D, Takusagawa HL, Sit AJ et al. OCT angiography for the diagnosis of glaucoma: A report by the American Academy of Ophthalmology. Ophthalmology. 2021;128(8):1222-35.
[4] Kamalipour A, Moghimi S, Khosravi P et al. Combining optical coherence tomography and optical coherence tomography angiography longitudinal data for the detection of visual field progression in glaucoma. Am J Ophthalmol. 2023;246:141-54.
[5] Moghimi S, Bowd C, Zangwill LM et al. Measurement floors and dynamic ranges of OCT and OCT angiography in glaucoma. Ophthalmology. 2019;126(7):980-8.
[6] Hayek S, Labbé A, Brasnu E et al. Optical coherence tomography angiography evaluation of conjunctival vessels during filtering surgery. Transl Vis Sci Technol. 2019;8(4):4.
[7] Okamoto Y, Akagi T, Kameda T et al. Prediction of trabecular meshwork-targeted micro-invasive glaucoma surgery outcomes using anterior segment OCT angiography. Sci Rep. 2021;11(1):17850.
[8] Chihara E, Dimitrova G, Amano H, Chihara T. Discriminatory power of superficial vessel density and prelaminar vascular flow index in eyes with glaucoma and ocular hypertension and normal eyes. Invest Ophthalmol Vis Sci. 2017;58(1):690-7.