Acide hyaluronique de haut poids moléculaire : une molécule clé dans le domaine de l’ophtalmologie
Découvert en 1934 par des biochimistes américains, l’acide hyaluronique a été utilisé dès les années 1960 en ophtalmologie, et notamment dans la chirurgie de la cataracte, avant d’être appliqué à d’autres domaines en raison de ses nombreux bienfaits.
Un peu d’histoire
En 1934, les biochimistes Karl Meyer et John Palmer, qui travaillent dans le département d’ophtalmologie de l’université de Columbia aux États-Unis, isolent un nouveau polysaccharide dans l’humeur vitrée d’un œil de bovin [1]. Ils ont caractérisé sa structure primaire, constituée d’acide glucuronique et de N-acétylglucosamine, et l’ont nommé acide hyaluronique (AH) [2]. Dans les conditions physiologiques, il est retrouvé sous la forme d’hyaluronate de sodium.
Dans les années 1950, Karl Meyer met de nouveau en évidence la structure moléculaire (arrangement 3D) de l’AH, sous la forme d’hyaluronate de sodium dans le liquide synovial. Il s’intéresse à ses propriétés rhéologiques et aux bénéfices procurés.
À la fin des années 1960, cette molécule est utilisée dans le domaine de l’ophtalmologie, comme facteur de visco-supplémentation, lors de la chirurgie de la cataracte [3].
En 1972, Rydell, médecin et chercheur à Boston (Department of Connective Tissue Research, Boston Biochemical Research Institute), injecte avec succès un sel de l’AH dans les articulations de patients arthrosiques.
Enfin, dans les années 1990, les premières applications de l’AH apparaissent dans le domaine de la médecine esthétique. Depuis, cette molécule reconnue comme bénéfique et sans danger pour la santé humaine grâce à sa haute biocompatibilité est largement utilisée dans les domaines de l’ophtalmologie, la dermatologie, la gynécologie, la rhumatologie, la médecine esthétique ou la cosmétologie.
Structure chimique de l’acide hyaluronique
L’AH est un polysaccharide linéaire et non ramifié, constitué de 2 molécules de base, l’acide D-glucuronique et la N-acétylglucosamine, reliées par des liaisons glycosidiques alternées bêta-1,4 et bêta-1,3 (unités diholosides).
Des propriétés physico-chimiques uniques
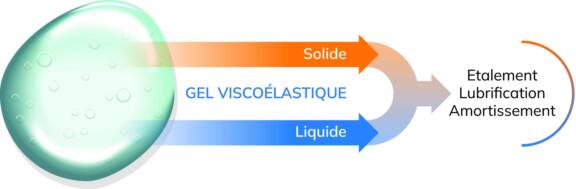
L’AH fait partie de la classe des glycosaminoglycanes non sulfatés. En solution, il adopte une structure qui génère ses propriétés visqueuses en formant des liaisons hydrogène avec l’eau. Ces liaisons renforcent la stabilité et la rigidité de la molécule. L’AH possède un fort pouvoir hygroscopique (forte rétention en eau) permettant la formation de gels viscoélastiques en solution.
Ainsi, l’AH n’a pas seulement des propriétés hygroscopiques, il a aussi des propriétés rhéologiques (comportement viscoélastique). La rhéologie correspond à l’étude de la déformation et de l’écoulement de la matière sous l’effet d’une contrainte appliquée. La viscosité correspond à la résistance à l’écoulement, tandis que l’élasticité est la capacité d’un matériau à être déformable sous la contrainte tout en reprenant sa forme d’origine [4].
La viscosité de l’AH dépend de la longueur des chaînes (poids moléculaire), du pH, de la force ionique du milieu ou des interactions avec les autres éléments de la formulation. Les sels d’AH présentent une bonne solubilité dans l’eau et possèdent une viscosité assez élevée, même à faible concentration, formant quelquefois des gels [5].
Points clés
• L’AH est un polysaccharide appartenant à la classe des glycosaminoglycanes.
• Il possède un pouvoir hygroscopique élevé.
• Formation réseau (gel). La viscosité dépend de la longueur des chaînes (PM).
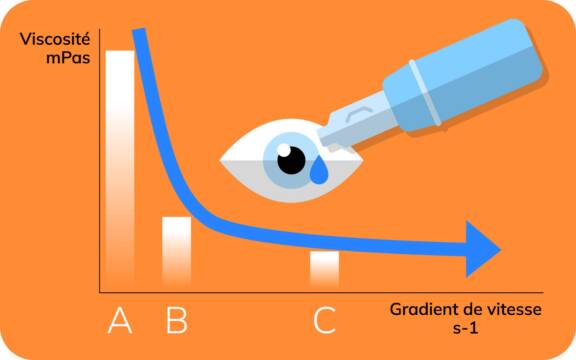
En effet, l’augmentation du gradient de cisaillement ou de vitesse (sollicitation mécanique sur le produit) affecte la structure du système, ce qui provoque l’alignement des chaînes du polymère dans le sens de l’écoulement, et donc la chute de la viscosité. Au repos, le collyre a une viscosité élevée (A est un gradient proche de 0), qui va baisser fortement en fonction de la sollicitation – en B le gradient proche de 50 à 100 s-1 correspondant à la sortie du collyre de son flacon – et une viscosité minimale quand la paupière cisaille le produit – gradient de vitesse en C proche de 1200 s-1 [7].
En résumé, la viscosité de l’AH diminue du fait des forces de cisaillement, ce qui va favoriser son étalement. Ainsi, entre chaque clignement de l’œil, la viscosité va augmenter, permettant un contact prolongé au niveau de la surface oculaire [8]. Une viscosité suffisamment élevée au repos assure la rémanence de la formulation, et donc son efficacité.
Points clés
• Comportement rhéologique non newtonien rhéofluidifiant (la viscosité baisse en fonction de la sollicitation) : intérêt dans la rémanence et l’étalement.
• Propriétés viscoélastiques : rémanence et lubrification.
Propriétés d’hydratation et osmolarité
Lors de la sécheresse oculaire, l’hyperévaporation et le déficit de la sécrétion aqueuse ont été mis en évidence. Ces mécanismes peuvent entraîner une hyperosmolarité lacrymale, qui génère une déshydratation des cellules épithéliales cornéennes et conjonctivales. Il existe sur le marché des substituts lacrymaux hypo-osmotiques qui permettent de diminuer la pression osmotique au niveau du film lacrymal. L’effet est considéré comme limité dans le temps [7,9].
Il est donc important d’hydrater ou de compenser le déficit sécrétoire. La molécule d’acide hyaluronique comporte un nombre élevé de charges négatives. Cette structure explique sa bonne rétention des molécules d’eau car les liaisons hydrogène formées se révèlent plus nombreuses et plus fortes avec les charges négatives [10]. Le haut poids moléculaire de l’AH optimise les capacités de liaison à l’eau mais également les propriétés lubrifiantes [11] (figure 3). Les AH de haut poids moléculaire (HPM-HA) se caractérisent également par des propriétés filmogènes sur la peau ou les muqueuses, permettant le maintien d’un environnement fortement hydraté et la régulation de la balance osmotique [12].
Propriétés de muco-adhésion
Les cellules caliciformes, l’épithélium conjonctival et l’épithélium cornéen sont responsables de la sécrétion de mucine (glycoprotéines) formant le mucus. Lors du phénomène de muco-adhésion, c’est-à-dire l’interaction entre cette couche de mucus et l’AH, on observe une augmentation de la mouillabilité. Cela entraîne le gonflement de l’AH et l’enchevêtrement des couches de mucus et de l’AH. Des liaisons se forment alors entre les molécules [13]. Cette interaction permet le maintien de l’eau et donc la rémanence au niveau des tissus.
Points clés
• La muco-adhésion est une interaction entre la mucine et un polymère, en l’occurrence l’AH.
• Au niveau de l’œil, la mucine est sécrétée par les cellules caliciformes, l’épithélium conjonctival et cornéen.
• La muco-adhésion est d’autant plus élevée que le poids moléculaire de l’HA est important.
• Cette propriété est en relation avec la rémanence du produit.
Propriétés biologiques
Acide hyaluronique et processus inflammatoire
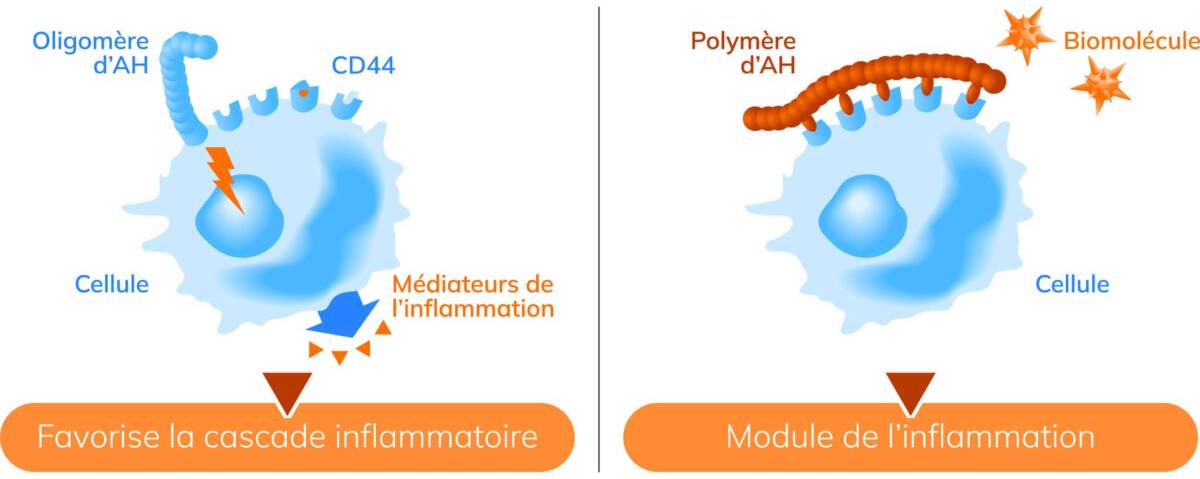
Les propriétés biologiques de l’AH sont liées à son interaction avec la glycoprotéine CD44, principal récepteur de la molécule, associée à la libération des signaux inflammatoires, à l’induction de la prolifération et de la migration cellulaire [15,16].
L’affinité de l’AH pour le CD44 dépend de sa masse molaire, elle est notamment liée à la longueur de la chaîne polysaccharidique.
Les AH de bas poids moléculaire (BPM-HA) sont à l’origine d’une réponse pro-inflammatoire, en augmentant l’expression de différentes cytokines inflammatoires [15]. Cette réponse est activée via le récepteur CD44. Des récepteurs comme les Toll-like receptors sont également impliqués dans la signalisation. Les fragments de bas poids moléculaire peuvent se lier aux Toll-like receptors (TLR2 et TLR4) des monocytes, des cellules dendritiques et des lymphocytes pour déclencher une réponse pro-inflammatoire. Des oligomères de faible poids moléculaire (10 à 20 kDA) sont antigéniques, immunostimulants et pro-inflammatoires. Ces oligomères entraînent une stimulation de l’expression d’IL1-β et de TNF-α et se comportent intrinsèquement comme des médiateurs pro-inflammatoires, particulièrement les fragments de 200 à 250 kDA [12].
Les AH de haut poids moléculaire (1250 kDAs) inhibent la réponse inflammatoire déclenchée après la stimulation des macrophages par les lipopolysaccharides (LPS). Ils induisent donc un effet anti-inflammatoire dose-dépendant, notamment en inhibant l’activation du facteur de transcription NF-kappa B [17]. Ils ont des propriétés anti-angiogéniques et immunosuppressives. Dans le cas de l’AH de haut poids moléculaire, la liaison HPM-CD44 recouvre la membrane cellulaire et freine l’apoptose, contrairement aux AH de bas poids moléculaire [18] (figure 5).
Acide hyaluronique et cicatrisation
L’AH joue un rôle pivot dans la cicatrisation et son implication est dépendante de son poids moléculaire [12,19].
• Les oligomères d’AH interviennent lors de la phase vasculaire et inflammatoire et favorisent l’élimination des débris cellulaires. Dans le processus de la cicatrisation, les AH de bas poids moléculaire activent le système immunitaire [12].
• Les polymères d’AH sont impliqués lors de la phase proliférative et de remodelage. Ils favorisent la prolifération et la migration cellulaire ainsi que l’angiogenèse. Les hauts poids moléculaires créent un microenvironnement favorable à la cicatrisation des tissus [12]. D’ailleurs, Wu et al. ont montré que des acides hyaluroniques de haut poids moléculaire (1 525 kDA) exerçaient des effets cytoprotecteurs supérieurs à ceux de bas poids moléculaire (125 kDA). À 0,30%, ils facilitent la migration cellulaire et la cicatrisation des plaies [20]. Le phénomène de différenciation cellulaire, important dans le phénomène de la cicatrisation, dépend de la masse moléculaire des acides hyaluroniques impliqués [21].
Conclusion
En sécheresse oculaire, le poids moléculaire des AH est essentiel lors de la formulation des collyres. Nous avons vu précédemment que le poids moléculaire et la concentration en AH allaient entraîner des conséquences à différents niveaux.
Ils ont une influence sur la viscosité des formulations, sur la formation d’un réseau plus ou moins structuré, sur les caractéristiques viscoélastiques et sur l’interaction avec le mucus. Ainsi, la structure va avoir un impact sur la rétention de l’eau, l’hydratation, la rémanence et les qualités de lubrification.
Ils possèdent des propriétés biologiques via des interactions avec différents récepteurs, et notamment CD44. Les AH de haut poids moléculaire sont intéressants pour leurs propriétés anti-inflammatoires [22], cryoprotectrices, de cicatrisation, notamment de l’épithélium cornéen [23]. D’ailleurs, dans un article de 2020, Wolfgang G.-K. Müller-Lierheim [24] souligne que les collyres à base d’AH de haut poids moléculaire présentent des caractéristiques intéressantes et adaptées à l’ophtalmologie.
Leur structure est proche de celle des AH naturels de la surface oculaire. Des études montrent également que chez certains patients, ce type de forme pharmaceutique peut être supérieur au sérum autologue.
Les caractéristiques de la formulation, en fonction du type d’AH, de sa concentration, de ses caractéristiques rhéologiques et des actifs associés permettront au clinicien de s’adapter au patient ainsi qu’à la pathologie et son évolution.
Références bibliographiques
[1] McDonald J, Hascall VC. Hyaluronan minireview series. J Biol Chem. 2002;277(7):4575-9.
[2] Aragona P, Simmons PA, Wang HP, Wang T. Physicochemical properties of hyaluronic acid–based lubricant eye drops. Transl Vis Sci Technol. 2019;8(6):2.
[3] Martin JP. Tout (ou presque) sur l’acide hyaluronique. La Revue de mésothérapie. 2007;129.
[4] Couarraze G, Grossiord JL, Huang N. Initiation à la rhéologie (4° Éd.). Bases théoriques et applications expérimentales. Édition Lavoisier. 2014.
[5] Nusgens BV. Hyaluronic acid and extracellular matrix: a primitive molecule? Annales de dermatologie et de vénéréologie. 2010;137 Suppl 1:S3-8.
[6] Hynnekleiv L, Magno M, Ragnheidur RR et al. Hyaluronic acid in the treatment of dry eye disease. Acta Ophthalmol. 2022;100(8):844-60.
[7] Magnin A, de Loubens C. La rhéologie des substituts lacrymaux au service de l’ophtalmologiste. Compte rendu de la Société d’ophtalmologie de Paris. 2009.
[8] Laluque L. Acide hyaluronique une molécule primitive : intérêts et emplois en pharmacie d’officine. Thèse pour l’obtention du diplôme d’État de docteur en pharmacie, université de Bordeaux. 2020.
[9] Duprez J. Traitements innovants dans la sécheresse oculaire : revues de la littérature et des études en cours. Thèse pour l’obtention du diplôme d’État de docteur en pharmacie, université de Picardie. 2017.
[10] Masson F. Skin hydration and hyaluronic acid. Ann Dermatol Venereol. 2010;137 Suppl 1:S23-5.
[11] Chang WH, Liu PY, Lin MH et al. Applications of hyaluronic acid in ophthalmology and contact lenses. Molecules. 2021;26(9):2485.
[12] Gall Y. Hyaluronic acid : structure, metabolism and implication in cicatrisation. Ann Dermatol Venereol. 2010:137 Suppl 1:S30-9.
[13] Horvát G. Mucoadhesive polymers in ophthalmic therapy. Ph. D. Thesis. University of Szeged. 2015.
[14] Guarise C, Acquasaliente L, Pasut G et al. The role of high molecular weight hyaluronic acid in mucoadhesion on an ocular surface model. J Mech Behav Biomed Mater. 2023:143:105908.
[15] Marinho A, Nunes C, Reis S. Hyaluronic acid: A key ingredient in the therapy of inflammation. Biomolécules. 2021;11(10):1518.
[16] Yu PH, Chou PY, Wan-Ning Li WN et al. The pro-inflammatory and anti-inflammatory role of hyaluronic acid in endometriosis. Taiwan J Obstet Gynecol. 2021;60(4):711-7.
[17] Lee BM, Park SJ, Noh I, Kim CH. The effects of the molecular weights of hyaluronic acid on the immune responses. Biomater Res. 2021;25(1):27.
[18] Kojima T, Nagata T, Kudo H et al. The Effects of high molecular weight hyaluronic acid eye drop application in environmental dry eye stress model mice. Int J Mol Sci. 2020;21(10):3516.
[19] David-Raoudi M, Tranchepain F, Vincent JC et al. Differential effects of hyaluronan and its fragments on fibroblasts: Relation to wound healing. Wound Repair Regen. 2008;16(2):274-87.
[20] Wu CL, Chou HC, Li JM et al. Hyaluronic acid-dependent protection against alkali-burned human corneal cells. Electrophoresis. 2013;34(3):388-96.
[21] Maharjan AS, Pilling D, Gomer RH. High and low molecular weight hyaluronic acid differentially regulate human fibrocyte differentiation. P PLoS One. 2011;6(10):e26078.
[22] Beck R, Stachs O, Koschmieder A. Hyaluronic acid as an alternative to autologous human serum eye drops: Initial clinical results with high-molecular-weight hyaluronic acid eye drops. Case Rep Ophthalmol. 2019;10(2):244-55.
[23] Nguyen L, Lin X, Verma S et al. Characterization of the molecular weight of hyaluronan in eye products using a novel method of size exclusion high-pressure liquid chromatography. Transl Vis Sci Technol. 2023;12(4):13.
[24] Müller-Lierheim WG. Why chain length of hyaluronan in eye drops matters. Diagnostics (Basel). 2020;10(8):511.
![Figure 3. Structure et interaction de l’AH en solution [20].](http://cdn.cahiers-ophtalmologie.fr/img/f5b/piccerelle-figure-3_lg.jpg)
![Figure 4. Composants classiques de larmes artificielles et muco-adhésion. En haut. Tableau avec la concentration et l’effet des ingrédients testés sur les propriétés rhéologiques après dilution 1:1 avec 8% de MUC2. En bas. Propriétés muco-adhésives d’une série d’humectants, de désémulsifiants et d’agents gélifiants à la concentration classique des larmes artificielles sur le marché et corrélation linéaire entre l’AH MM linéaire (à 1,4 mg/mL) et l’indice de muco-adhésivité [14]. HA : Acide hyaluronique ; HBC : Acide hyaluronique réticulé ; CMC : Carboxymethylcellulose ; MM : Masse moléculaire ; MUC2 : Mucine 2 ; MW : Poids moléculaire. ](http://cdn.cahiers-ophtalmologie.fr/img/e81/piccerelle-figure-4_md.jpg)